LAPORAN LENGKAP
Nama : Irene Pratami Raratunasah Naddu
Kelas/NIS : 3.C / 114675
Kelompok : C.2.1
Tanggal Mulai : 28 April 2014
Tanggal Selesai : 28 April 2014
Judul Penetapan : Uji Biuret
Tujuan Penetapan : Untuk mengetahui ada atau tidaknya protein dalam pupuk UREA
Dasar Prinsip : 2 molekul UREA pada suhu tinggi bergabung atau berpolimerisasi
membentuk senyawa biuret. Keberadaannya dapat diketahui
dari reaksi biuret dengan garam tembaga kompleks membentuk
kompleks yang berwarna lembayung.
Landasan Teori :
membentuk senyawa biuret. Keberadaannya dapat diketahui
dari reaksi biuret dengan garam tembaga kompleks membentuk
kompleks yang berwarna lembayung.
Landasan Teori :
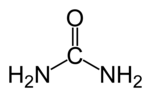
Urea adalah senyawa organik yang tersusun dari unsur karbon, hidrogen, oksigen dan nitrogen dengan rumus CON2H4 atau (NH2)2CO.
Urea juga dikenal dengan nama carbamide yang terutama digunakan di kawasan Eropa. Nama lain yang juga sering dipakai adalah carbamide resin, isourea, carbonyl diamide dan carbonyldiamine. Senyawa ini adalah senyawa organik sintesis pertama yang berhasil dibuat dari senyawa anorganik, yang akhirnya meruntuhkan konsepvitalisme.
Urea terbentuk melalui proses oksidasi yang terjadi pada hati. Eritrosit atau sel darah merah yang sudah rusak (120 hari) dirombak menjadi 'haemo' dan'globin'. Selanjutnya 'haemo' akan diubah menjadi zat warna empedu yaitu bilirubin dan urobilin yang mengandung urea dan amonia yang akan keluar bersama urin dan feses.
Sekitar 90% urea industri digunakan sebagai pupuk kimia. Urea dalam bentuk butiran curah (prill) digunakan dalampertanian sebagai pupuk kimia pemasok unsur nitrogen. Di tanah, urea akan terhidrolisis dan melepaskan ionamonium. Kandungan N pada urea adalah 46%, tetapi yang tergunakan oleh tanaman biasanya separuhnya.
Karena penting dalam pembangunan pertanian, pupuk urea seringkali disubsidi oleh pemerintah suatu negara, termasuk Indonesia. Di pasaran Indonesia, pupuk urea dipasarkan dalam dua bentuk: bersubsidi (berwarna merah muda, digunakan untuk bantuan pembangunan) dan tidak bersubsidi (berwarna putih, untuk dipasarkan secara komersial).
Pupuk urea dihasilkan sebagai produk samping pengolahan gas alam atau pembakaran batu bara. Karbon dioksida yang dihasilkan dari kegiatan industri tersebut lalu dicampur dengan amonia melalui proses Bosch-Meiser. Dalam suhu rendah, amonia cair dicampur dengan es kering (karbondioksida) menghasilkan amonium karbamat. Selanjutnya, amonium karbamat dicampur dengan air ditambah energi untuk menghasilkan urea dan air.
Sekitar 90% urea industri digunakan sebagai pupuk kimia. Urea dalam bentuk butiran curah (prill) digunakan dalampertanian sebagai pupuk kimia pemasok unsur nitrogen. Di tanah, urea akan terhidrolisis dan melepaskan ionamonium. Kandungan N pada urea adalah 46%, tetapi yang tergunakan oleh tanaman biasanya separuhnya.
Karena penting dalam pembangunan pertanian, pupuk urea seringkali disubsidi oleh pemerintah suatu negara, termasuk Indonesia. Di pasaran Indonesia, pupuk urea dipasarkan dalam dua bentuk: bersubsidi (berwarna merah muda, digunakan untuk bantuan pembangunan) dan tidak bersubsidi (berwarna putih, untuk dipasarkan secara komersial).
Pupuk urea dihasilkan sebagai produk samping pengolahan gas alam atau pembakaran batu bara. Karbon dioksida yang dihasilkan dari kegiatan industri tersebut lalu dicampur dengan amonia melalui proses Bosch-Meiser. Dalam suhu rendah, amonia cair dicampur dengan es kering (karbondioksida) menghasilkan amonium karbamat. Selanjutnya, amonium karbamat dicampur dengan air ditambah energi untuk menghasilkan urea dan air.
Uji biuret digunakan untuk menunjukkan adanya ikatan peptida dalam suatu zat yang diuji. Adanya ikatan peptida mengindikasikan adanya protein, karena asam amino berikatan dengan asam amino yang lain melalui ikatan peptida membentuk protein. Ikatan peptida merupakan ikatan yang terbentuk ketika atom karbon dari gugus karboksil suatu molekul berikatan dengan atom nitrogen dari gugus amina molekul lain. Reaksi tersebut melepaskan molekul air sehingga disebut reaksi kondensasi.
Gambar di atas menunjukkan adanya dua molekul asam amino yang berikatan dengan ikatan peptida dan membentuk molekul protein. Ikatan peptida tersebut yang akan bereaksi dengan reagen biuret menghasilkan perubahan warna. Reaksi positif uji biuret ditunjukkan dengan munculnya warna ungu atau merah muda akibat adanya persenyawaan antara Cu++ dari reagen biuret dengan NH dari ikatan peptida dan O dari air. Semakin panjang ikatan peptida (banyak asam amino yang berikatan) akan memunculkan warna ungu, semakin pendek ikatan peptida (sedikit asam amino yang berikatan) akan memunculkan warna merah muda.
Alat : - Tabung reaksi
- Pipet tetes
Bahan : - Pupuk UREA
- Aquadest
- NaOH 0,1 N
- CuSO4
Cara Kerja :
- Dilarutkan contoh ke dalam tabung reaksi dengan aquadest.
- Dibubuhi beberapa tetes larutan CuSO4 dan NaOH 30 %
- Bila terbentuk warna lembayung maka biuret (+)
Pengamatan :
Larutan berwarna biru
Kesimpulan :
Berdasarkan hasil pengamatan tersebut dapat disimpulkan bahwa dalam pupuk UREA tidak mengandung protein.
Daftar Pustaka :
http://pendidikan-bio.blogspot.com/2013/11/uji-biuret.html
http://distan.riau.go.id/index.php/component/content/article/53-pupuk/141-unsur-hara-pupuk










![E = E^0 + f\frac{RT}{nF} \log_e[\mbox{H}^+]](http://upload.wikimedia.org/math/1/0/6/10665ee41eae75113e529058df52a5a1.png)
